Scorpion optimiert für Normalisierung von Nukleinsäuren

Das Profil des bekannten Hochgeschwindigkeitsdispensers „Scorpion“ von Art Robbins Instruments wurde erweitert für „Normalisierungsanwendungen von Nukleinsäuren“. In Kooperation mit der Firma Avrok Biosciences konnte herausgefunden werden, dass der Scorpion in der Lage ist, volumetrische Transfers und Normalisierung von Nukleinsäuren mit einem CV kleiner als 5 % und einer Standardabweichung von 0,11 durchzuführen.
Der „Scorpion“ wurde für diese neue Anwendung optimiert und ist nun mit einer dafür speziell zugeschnittenen Software, welche den Anwender Schritt-für-Schritt durch das Protokoll führt, ausgestattet, so dass auch neue Nutzer sich schnell in die Bedienung des Gerätes einfinden. Die neue Anwendung funktioniert reibungslos durch das einfache Einbringen einer CSV-Datei auf das Gerät. Anwender müssen lediglich das gewünschte Volumen und die Konzentration eingeben, so dass die Software benötigte Volumina und Verdünnungen selbst berechnen kann.
Das System kann Volumina von 1 µl bis 1000 µl mit einer Einkanalspitze transferieren, die an einem Tripodarm befestigt ist, so dass jede Position innerhalb des Gerätes erreicht werden kann.
Insgesamt bietet das Deck vom „Scorpion“ Platz für bis zu 6 Positionen, die mit allen Platten im SLAS/ANSI Format wie z. B. PCR-Platten für Normalisierung, Halterungen für zahlreiche Röhrchengrößen wie 50 ml, 15 ml und 1,5 ml, Pipettenspitzenhalterungen sowie Adapter für Linbro-Platten bestückt werden können. Zusätzlich sind spezielle Halterungen für Objektträger, welche zwei Deckpositionen einnehmen, verfügbar. Kundenspezifische Halterungen sind ebenfalls möglich. Bitte kontaktieren Sie uns dafür.
Das System ist sehr robust und wartungsfrei, so dass ein zuverlässiger Einsatz in Produktionsprozessen möglich ist.
Bitte kontaktieren Sie uns für weitere Informationen.
Kontakt:
Dr. Kevin Denkmann • Geschäftsführer
Dunn Labortechnik GmbH• Thelenberg 6 • 53567 Asbach
Tel. 02683 4 30 94 • Fax 02683 4 27 76
E-Mail: info@dunnlab.de • Internet: www.dunnlab.de
Themenwochen Innovation bei Regio TV: Im Gespräch mit SVP Kai Vogt

Innovation: Teil unserer DNA
Der Sender Regio TV widmet sich regelmäßig wichtigen wirtschaftlichen und gesellschaftlichen Entwicklungen in Baden-Württemberg. In der Themenwoche „Innovation und Zukunft“ porträtierte der Sender täglich ein Unternehmen der Region, das dabei besonders hervorsticht – so auch Vetter als Global Player der Pharmabranche und einer der größten Arbeitgeber der Region. Eingeladen zum Gespräch war Kai Vogt, unser Senior Vice President für Corporate Development, Legal, IT & Innovation.
Die Pharmaindustrie – und vor allem Vetter als Spezialist für die Abfüllung komplexer Injektionssysteme – muss sehr strenge Auflagen erfüllen, um eine größtmögliche Sicherheit für Patientinnen und Patienten zu gewährleisten. Kai Vogt berichtete davon, wie es Vetter trotz dieser Vorgaben gelingt, innovativ zu sein, zu bleiben – und Innovation sogar in seiner Unternehmens-DNA verankert hat. So entwickelt und testet etwa das Team Innovation Partner im geschützten Rahmen neue Ideen. Als Beispiele nannte Vogt auch die Vetter-Hackathons oder das Innovation World Café, das bereits dreizehnmal stattgefunden hat.
Zum Abschluss betonte Kai Vogt die Erfolge dieser Innovationskultur bei Vetter. Sie zeigen sich auf vielerlei Weise durch die Verbesserung von Prozessen und Technologien – aber auch bei der Zusammenarbeit aller Mitarbeitenden. Ein Beispiel ist der vor einigen Monaten eingerichtete interne Chatbot oder der Speed Bin Picker, der monotone Aufgaben in der Produktion übernimmt und für den wir bereits ausgezeichnet wurden.
Sehen Sie sich das Gespräch in ganzer Länge (5:15 min) an:
YUMAB – pioneering antibody discovery since 2012

From target discovery to fully characterized lead – our experienced team leads biotech and pharma teams worldwide through the development process as your trusted, de-risking partner.
Das Flexcell® Compression System für zelluläre Biomechanik-Anwendungen

Dunn Labortechnik bietet seitvielen Jahren exklusiv in Europa und dem Nahen Osten die gesamte Produktpaletteder amerikanischen Firma Flexcell International an.
Das innovative FlexcellCompression System FX-5000C™ wurde speziell für die in vitro Analyse vonbiomechanischen Untersuchungen von Zellkulturen entwickelt. Es handelt sich umein computergesteuertes Bioreaktorsystem, das einen regulierbaren Luftdrucknutzt, um in vitro Gewebeproben oder 3D Zellkulturen physiologischen invivo Druckbedingungen auszusetzen und deren Auswirkungen zu testen. Dabeilassen sich nicht nur unterschiedliche Druckstärken auf Zellen untersuchen,das Compression System erlaubt dem Anwender auch, diesen Druck sowohl statischals auch dynamisch (einstellbare Frequenz und Wellenform) auf die 3D-Zellkonstrukteoder Gewebeproben anzuwenden.
Zusätzlich zum FX-5000C™ Systembietet Flexcell eine Reihe weiterer Systeme an, die dem Anwender gewähren,andere Belastungsarten, z.B. Dehnungs- oder Scherkräfte, zu untersuchen und dadurchdie gewünschte Simulation von in vivo Bedingungen für Zellen u.a. ausMuskel, Lunge, Herz, Blutgefäßen, Haut, Sehnen, Bändern, Knorpel oder Knochenzu ermöglichen.
Bitte kontaktieren Sie uns für detaillierte Informationen oder besuchenunsere Webseite www.dunnlab.de
37. BioTechnologie Kursbuch erschienen

Um internationale Wettbewerbsfähigkeit geht es inzwischen auch inder Biotechnologie-Branche, auf deren Produkten und Dienstleistungen großeHoffnungen unter anderem im Kampf gegen die Klimaerwärmung ruhen. Gesundheitund Nachhaltigkeit sind die Megatrends unserer Zeit. Deshalb ist es keinWunder, dass die Biotechnologie-Branche in Deutschland, der Schweiz undÖsterreich entgegen der allgemeinen Stagnation in der Wirtschaft stetig weiterwächst. Sogar ein Bau-Boom für neue Labor- und Produktionsräume ist zuverzeichnen. Die neuesten Branchen-Daten nach Standards der OECD finden sich im37. Jahrgang des BioTechnologie Kursbuches. Dazu gibt es hierHintergrundberichte über die aktuellen Trends, etwa neue Treibstoffe für dieKlimarettung, wie es um die Neuen Genomischen Techniken (NGTs) in Europa stehtoder wieso die moderne Präzisionsfermentation eine positive Vision darstellt.Auch Sorgen werden angesprochen: In der Biotechnik drohen die USA Europaabzuhängen. Kurz: Viel Lesestoff für alle, die sich über den Stand der Dingebei dieser immer noch unterschätzten Zukunftstechnologie informierenwollen.
BioTechnologie Kursbuch 2024
37. Jahrgang
160 Seiten
BIOCOM, Berlin
ISBN 978-3-928383-92-9
erhältlich u. a. bei biospheria.shop
Pipeline in a molecule – ein innovativer Ansatz mit Breitbandeffekt
Das IZB-Unternehmen Atriva Therapeutics arbeitet daran, die globale Bedrohung durch von RNA-Viren verursachte Epidemien und Pandemien zu minimieren. Der Lead-Kandidat Zapnometinib hat bereits relevante Phase 2-Daten generiert und soll als nächstes in einer Proof-of-Concept-Studie bei Patienten mit schwerer hospitalisierter Influenza getestet werden.
© iStock / parinyabinsuk
Ein Gespräch mit dem CEO Christian Pangratz über ein potenzielles Breitband-Virostatikum, das laufende Fundraising und die Gefahren der nächsten Grippewelle.
Herr Pangratz, Sie sind seit über 25 Jahren in der Biotech- und Pharmaindustrie tätig, seit Anfang 2023 als CEO von Atriva. Was ist für Sie das Besondere an diesem Unternehmen?
Das Besondere an Atriva ist die Einzigartigkeit der Technologie, die dieses Unternehmen entwickelt hat, in Kombination mit den Experten auf Personal- und auf Führungsebene, die ich von meinem Vorgänger mit übernehmen durfte. Einen besonderen Stellenwert nehmen auch die wissenschaftlichen Gründer ein, die das Unternehmen weiterhin mit ihrem Know-how unterstützen und sowohl für die interne Entwicklung als auch für Partner- und Finanzierungsgespräche äußerst wertvoll für Atriva sind.
Atriva entwickelt Therapien für schwere virale Infektionskrankheiten der Atemwege, beispielsweise Influenza oder Covid-19. Wie funktioniert Ihr Ansatz?
Wir zielen auf einen Signalweg in der Wirtszelle ab, der für zwei Dinge gleichzeitig verantwortlich ist. Erstens unterbindet er die Möglichkeit des replizierten Virusmaterials, aus der Wirtszelle wieder austreten und die Infektion weitertragen zu können. Gleichzeitig ist dieser Signalweg aber auch dafür zuständig, die Immunreaktion, die bei einer schweren viralen Infektion dazu neigt, massiv zu überschießen, wieder so runterzuregulieren, dass sie auf einem vernünftigen Niveau ist. Durch diese Kombination von indirekter antiviraler Wirkung und Immunmodulation erzielen wir ein optimales therapeutisches Ergebnis, insbesondere bei schwer erkrankten Patienten. Diese Patienten leiden nicht mehr unter einer hohen Viruslast, da diese im Krankheitsverlauf wieder nach unten geht, aber sie leiden an schweren Symptomen aufgrund der überschießenden Immunreaktion. Daher ist es wichtig, beide Seiten gut bedienen zu können: Die antivirale Seite und die immunmodulatorische Seite durch das Einfangen von überschießenden Immunreaktionen.
Was unterscheidet diesen Ansatz von anderen antiviralen Therapien?
Der große Unterschied ist, dass die meisten bisher verfügbaren Therapeutika auf das Virus direkt abzielen, also direkt wirksame Virostatika sind. Diese haben den potenziellen Nachteil, dass virale Resistenzen entstehen können, weil das Medikament mit einem mutierten Virus aufgrund seiner geänderten Struktur nicht mehr zurechtkommt. Wir hingegen sind die ersten, die ein Projekt in der fortgeschrittenen klinischen Entwicklung haben, das sich eines sogenannten Wirtszell-Mechanismus bedient und damit von Virusmutationen völlig unabhängig ist. Wir regulieren einen Signalweg herunter, den RNA-Viren grundsätzlich brauchen, um sich in der Wirtszelle zu replizieren. Daher können wir eine ganze Bandbreite von RNA-Viren behandeln, weil sie alle denselben Replikations- und immunmodulatorischen Signalweg brauchen. Ich würde es eine Art Penicillin der Virostatika nennen, nur eben ohne die potenzielle Resistenzentwicklung. Die Novität ist also die uneingeschränkt breite Einsetzbarkeit bei RNA-Virusinfektionen. Diese „Pipeline in a molecule“, über die Atriva hier verfügt, ist einzigartig.
Atrivas Lead-Programm Zapnometinib wurde klinisch in einer Phase 2a-Studie bei schwer erkrankten COVID-19-Patienten getestet. Was können Sie zu den Daten aus dieser Studie sagen?
Die Daten dieser Proof-of-Concept-Studie sind sehr vielversprechend, auch wenn wir die Studie aufgrund des Pandemieverlaufs nicht zu Ende führen konnten. Das hängt damit zusammen, dass wir mit unserer Therapie jene Patienten behandeln möchten, für die es keine oder nur sehr limitiert wirksame therapeutische Maßnahmen gibt – also die moderat bis schwer erkrankten Patienten, die im Krankenhaus sind. In unserer Studie bei Patienten, die mit einer Covid-19 Infektionen hospitalisiert wurden, konnten wir eine gute therapeutische Wirkung sehen bei ebenfalls guter Sicherheit und Verträglichkeit. Das führte auch zu einer verkürzten Verweildauer im Krankenhaus, was für die Kosten im Gesundheitssystem äußerst relevant ist. Sprich: die Patienten hatten nicht nur einen therapeutisch starken Effekt, sondern konnten auf Basis dieser guten Wirksamkeit auch das Krankenhaus früher verlassen. Das ist im Prinzip eine Traumkombination.
Aufgrund des Verlaufs der Pandemie konnten wir die Studie nicht komplett ausrekrutieren, sondern mussten nach der Hälfte aufhören. Mit den eingeschlossenen 100 von 220 geplanten Patienten, von denen etwa die Hälfte auf Placebo und die Hälfte auf Verum waren, haben wir aber eine sehr substanzielle Datenbasis, von der wir extrapolieren können und genau sehen, dass die Therapie funktioniert und sicher ist. Wir haben also, wie es so schön im Fachjargon heißt, medizinisch hoch relevante Daten erhoben, die aber nicht statistisch signifikant sind.
Welche weiteren Schritte planen Sie für Ihr Lead-Programm?
Nachdem die Pandemie beendet und Covid-19 als Indikation nicht mehr finanzierbar ist, haben wir uns entschlossen, wieder zurückzugehen zu unserem Ursprung. Atriva wurde 2015 als Influenza-Unternehmen gegründet und als wir so weit waren, in die Klinik gehen zu können, kam die Pandemie und wir wurden mittels finanzieller Unterstützung der deutschen Regierung und Europäischen Investitionsbank motiviert, unser Lead-Programm Zapnometinib in Covid-19 zu testen – was wir auch getan haben. Als nächstes werden wir eine Phase 2 Proof-of-Concept-Studie bei Patienten, die mit einer schweren Influenza-Infektion hospitalisiert werden, durchführen. Für diese Patienten gibt es heute keine einzige zugelassene Therapie, da bei schweren Krankheitsverläufen direkt wirksame Virostatika keine Wirksamkeit mehr zeigen. Wenn man mit Ärzten in Krankenhäusern spricht, sind die oft verzweifelt, weil sie für diese Patienten nicht viel tun können, außer sie mit Sauerstoff zu versorgen und sie so gut wie möglich intensivmedizinisch zu stabilisieren. Das heißt, da gibt es ein riesiges ungedecktes Marktbedürfnis.
In Deutschland sind in guten Jahren maximal circa 50% der Bevölkerung gegen Influenza geimpft, das heißt, ein großer Teil der Bevölkerung bleibt völlig ungeschützt. Außerdem gibt es bei Influenza eine sehr hohe Anzahl an Durchbruchsinfektionen, gerade bei älteren Patienten, obwohl die Patienten geimpft sind. Das heißt, das Patientenvolumen, mit dem wir es hier zu tun haben, ist sehr groß, gerade was die schwere Influenza anbelangt. Patienten, die mit einer schweren Influenza-Infektion ins Krankenhaus kommen, bleiben meist lange dort, was die Gesundheitssystem richtig viel Geld kostet. Außerdem liegt die Mortalitätsrate dieser Patienten bei 10%. Das ist sehr viel – und die nächste Grippewelle steht immer schon vor der Tür.
Eine weitere mögliche Indikation von Zapnometinib ist RSV. Warum ist diese Indikation so wichtig?
Das Respiratorische Synzytial-Virus (RSV) stellt eine riesige Indikation dar, da reden wir über Dimensionen wie im Influenza-Bereich. Dieses Virus trifft in erster Linie die schwächsten Patienten in der Gesellschaft – entweder sehr junge Patienten, mit einem noch nicht voll entwickelten Immunsystem, oder Patienten im Alter von über 60 Jahren, die nicht selten schon ein weniger effizientes Immunsystem haben. Die Infektionsraten sind bei RSV sehr hoch und auch die damit verbundenen Mortalitätsraten.
Wie ist Atriva finanziert und welche weiteren Schritte planen Sie zur Finanzierung der nächsten Studie?
Bis dato ist Atriva durch Venture Capital finanziert. Das Kapital kommt aus verschiedensten Quellen, privaten und institutionellen. Meneldor ist unser Lead-Investor, ein holländischer Fonds, der Kapital poolt und in Biotech-Unternehmen investiert. Auch der High-Tech Gründerfonds gehört zu unseren Investoren. Darüber hinaus haben wir von der deutschen Bundesregierung im Rahmen der Entwicklung von Corona-Medikamenten eine Forschungsförderung bekommen und ein sogenanntes Venture-Darlehen von der Europäischen Investitionsbank. Insgesamt ist eine hohe zweistellige Millionensumme in das Unternehmen geflossen. Mit dem Geld sind wir sehr sorgsam umgegangen und haben schon viel erreicht. Wir haben erfolgreich die Präklinik abgeschlossen und zwei Phase 1-Studien durchgeführt, in denen wir die Sicherheit sowie das pharmakokinetische und pharmakodynamische Profil von Zapnometinib und die optimale Dosisstärke für die folgenden klinischen Studien bestimmen konnten. Und wir haben die eben beschriebene Phase 2a Proof-of-Concept-Studie bei moderat bis schwer erkrankten COVID-19 Patienten durchgeführt. Unterm Strich waren wir sehr kapitaleffizient und konnten mit dem Geld, das wir bisher eingeworben haben, ein Maximum an Daten generieren.
Der nächste Schritt ist jetzt eine Finanzierung in Höhe von 15 Mio. Euro, für die wir uns aktuell im Fundraising befinden. Mit den Mitteln möchten wir die zuvor genannte Phase 2 Proof-of-Concept-Studie in der schweren hospitalisierten Influenza abschließen und damit auch den Breitband-Virostatika-Aspekt, den wir mit Zapnometinib durch die Wirkweise in der Wirtszelle haben, mit klinischen Daten belegen.
Im Herbst 2022 sind Sie ins IZB eingezogen. Was waren die Gründe für diesen neuen Standort und was ist für Sie das Besondere am IZB?
Wir sind ans IZB gekommen, da wir uns aus einem stark forschungsorientierten Unternehmen immer mehr zu einem klinischen Entwicklungsunternehmen entwickelt haben. Die Infrastruktur, die wir hier im Großraum München und im IZB vorfinden, ist optimal für eine Projektentwicklungsgesellschaft, wie sie die Atriva heute ist. Ein Großteil des Führungsteams von Atriva war bereits im Großraum München angesiedelt, so dass es organisatorisch und inhaltlich sinnvoll war, den Forschungsstandort Tübingen nicht mehr weiterzuführen und den administrativen Standort Frankfurt mit all seinen Verantwortlichkeiten ins IZB zu verlegen. Das IZB ist die ideale Drehscheibe für uns. Wir arbeiten hier mit vielen anderen Biotech-Unternehmen zusammen, können unser Know-how mit anderen Firmen teilen und natürlich auch von denen profitieren. Es gibt hier einen sehr regen Austausch, der vom IZB im Rahmen zahlreicher Veranstaltungen unterstützt wird.
Aus Ihrer langjährigen Erfahrung heraus, welchen Ratschlag würden Sie jungen Gründern von Biotech-Startups mit auf den Weg geben, die noch ganz am Anfang ihrer Laufbahn stehen?
Ich glaube, der wichtigste Aspekt ist, sich nicht in die Wissenschaft zu verlieben, sondern sich gleichzeitig auch immer zu fragen: gibt es tatsächlich eine kommerzielle Anwendung für die wissenschaftlichen Aspekte und Erfindungen, die man gemacht hat und die man aus dem akademischen Bereich ausgründen möchte? Die Hürden sind sehr hoch geworden für die Finanzierung von jungen Unternehmen, der Wettbewerb ist intensiv. Es mangelt nicht an guten Ideen und an tollen Möglichkeiten, aber das Kapital ist sehr selektiv geworden. Daher ist es die Kombination aus kommerzieller Attraktivität und spannender Wissenschaft, die zum Erfolg führen wird.
- Am Klopferspitz 19
- 82152 Planegg-Martinsried
- Tel.: +49 7071 8597673
- moc.scituepareht-avirta@ofni
- https://www.atriva-therapeutics.com
Life Science Pitch Day im IZB: Innovationen treffen Investoren

≈Am 16. Juli 2024 veranstaltete das Münchner Innovations- und Gründerzentrum für Biotechnologie (IZB) in Zusammenarbeit mit dem High-Tech Gründerfonds (HTGF), Bayer, Boehringer Ingelheim und MEDICE den 9. Life Science Pitch Day, der zehn Biotech Start-ups mit mehr als 40 renommierten Life Science-Investor:innen und Entscheidungsträger:innen aus der Industrie zusammenbrachte.
©IZB/Dominik Gierke
Zunächst gab Christian Gnam, Geschäftsführer des IZB, einen Einblick in die Aktivitäten am Münchner Gründerzentrum und begrüßte als weitere Gastgeber Ingo Klöckner, Head of Portfolio and Reporting bei Leaps by Bayer und Philipp Müller, Executive Director beim Boehringer Ingelheim Venture Fund. Dr. Laura Pedroza, Investment Managerin des HTGF moderierte die Veranstaltung.
Die zehn ausgewählten Start-ups präsentierten ihre innovativen Ansätze zur Behandlung einer Vielzahl von schweren Erkrankungen, von bakteriellen Infektionen bis hin zu Hirntumoren. Im Anschluss hielt Dr. Daniel Vitt, CEO des IZB-Alumnus Immunic Therapeutics, eine Keynote-Speech über den Weg eines Biotech-Unternehmens zum erfolgreichen IPO.
„Auch in diesem Jahr wurde auf dem Life Science Pitch Day wieder Forschung auf höchstem Niveau präsentiert. Diese Veranstaltung bietet Start-ups die ideale Gelegenheit, in lockerer Atmosphäre wertvolles Feedback aus der Venture Capital-Szene zu erhalten. Ich danke unseren Partnern für ihre langjährige Unterstützung“, kommentiert Christian Gnam, Geschäftsführer des IZB.
„Die teilnehmenden Start-ups, die Life Science in innovative Lösungen umsetzen, konnten mit ihren Pitches begeistern“, freut sich Philipp Müller, Boehring Ingelheim Venture Fund.
„Beim Life Science Pitch Day ist das Networking von zentraler Bedeutung. Die Gründerinnen und Gründer haben die Chance, neue wertvolle Kontakte mit potenziellen Kapitalgebern, Partnerinnen und anderen Start-ups zu knüpfen“, erklärt Ingo Kloeckner, Leaps by Bayer.
„Mit dem Life Science Pitch Day haben wir gemeinsam ein ausgezeichnetes Event mit großem Mehrwert für alle Beteiligten etabliert. Hier entstehen Partnerschaften, von denen Life Science-Start-ups und Investor:innen profitieren“, so Dr. Laura Pedroza, HTGF.
Folgende Projektteams präsentierten ihre innovative Forschung am 9. Munich Life Science Pitch Day:
1. Akribion Therapeutics, Lukas Linnig: Eine neue Art der gesteuerten Zerstörung von Krebszellen, die auf die Expression krebsspezifischer RNA-Biomarker abzielt und leicht programmierbare zytotoxische Nukleasen mit hoher Spezifität für eine Vielzahl von RNA-Zielen verwendet
2. Citrapeutics, Prof. Frank Pressler: Erstklassige zielgerichtete ACOD1-Inhibitoren zur Stärkung der Anti-Tumor-Immunität und zur Hemmung der Vermehrung von Krebszellen für eine Reihe onkologischer Indikationen
3. immuneAdvice, Dr. Teresa Wagner: Visualisiert Immunzellen durch nicht-invasive Bildgebung, um Immuntherapien zu steuern
4. InCephalo Therapeutics, Carlo Bertozzi: Entwickelt Therapien der nächsten Generation zur Behandlung von Hirntumoren
5. KUPANDO, Johanna Holldack: Stimulierung des ältesten Verteidigungsmechanismus: TLRs erkennen Signaturmoleküle, die Infektionen und Krebs durch Aktivierung des angeborenen Immunsystems ankündigen
6. PREVACTA, Torsten Mummenbrauer, PhD: Ein Start-up für Impfstoffe und Therapeutika, das einzigartiges Fachwissen in den Bereichen synthetische (Glyko-) Chemie, Immunologie und klinische Infektionskrankheiten vereint
7. Quasar Therapeutics, Dr. Arthur Dopler: Entwickelt innovative Regulatoren des Komplementsystems, um seltene, aber lebensbedrohliche Krankheiten zu behandeln und die Probleme der derzeitigen Inhibitoren in der Klinik zu lösen
8. TECregen, Prof. Georg Hollander: Immuno-Rejuvenation Start-up mit der Vision, transformative, synthetische Liganden der nächsten Generation zur Regeneration des Thymus zu entwickeln
9. Teneura, Dr. Niels von Wardenburg: Zielt auf die Heilung neurologischer Autoimmunkrankheiten durch T-Zell-Therapien ab
10. TQ Therapeutics, Christin Zündorf: Entwickelt eine neuartige Herstellungsplattform für Zelltherapeutika, die die Produktion von zellulären Medikamenten mit einem integrierten, hochautomatisierten extrakorporalen Gentherapieansatz ermöglicht
Über das Innovations- und Gründerzentrum für Biotechnologie (IZB)
Die 1995 gegründete Fördergesellschaft IZB mbH betreibt das Innovations- und Gründerzentrum für Biotechnologie (IZB) mit den Standorten in Planegg-Martinsried und Freising-Weihenstephan. Das IZB zählt zu den führenden Biotechnologiezentren Europas. Auf 26.000 m2 sind derzeit mehr als 40 Biotech-Unternehmen und Life-Science-Firmen mit über 700 Mitarbeitern ansässig. Hier wird an der Entwicklung von Medikamenten gegen schwerste Krankheiten wie Krebs, Alzheimer und verschiedene Autoimmunkrankheiten gearbeitet. Ein wesentliches Kriterium für den Erfolg der IZBs ist die räumliche Nähe zur Spitzenforschung auf dem Campus Martinsried/Großhadern und dem Campus Weihenstephan. Auch die Infrastrukturmaßnahmen wie der Faculty Club G2B (Gateway to Biotech), das Hotel CAMPUS AT HOME, der Kindergarten Bio Kids sowie die Restaurants SEVEN AND MORE und THE BOWL Food Lounge sind Standortfaktoren, die von den Unternehmensgründern sehr geschätzt werden. Erfolgreiche Unternehmen, die aus dem IZB hervorgegangen sind, sind u. a. adivo (heute Zoetis), Corimmun (heute Janssen-Cilag), Crelux (heute Wuxi AppTec), Exosome Diagnostics (gekauft von Bio-Techne), ibidi, Immunic Therapeutics, Medigene, Micromet (heute Amgen), MorphoSys (bald Novartis), Octopharma oder Rigontec (heute MSD) sowie SIRION Biotech (heute Perkin Elmer). Weitere Informationen unter www.izb-online.de.
Pressekontakt:
Marion Köhler
Leitung Presse- und Öffentlichkeitsarbeit
Fördergesellschaft IZB mbH, Innovations- und Gründerzentrum Biotechnologie
Am Klopferspitz 19
D-82152 Planegg-Martinsried
Telefon: +49 (0)89/55 279 48-17
E-Mail: koehler@izb-online.de
Die Singulator™-Serie (100 und 200) Automatisierte Systeme zur Gewebedissoziation für Einzelzellanalysen

S2Genomics undder exklusive Distributor für Deutschland und Österreich, Dunn Labortechnik, präsentierendieSingulator™ Systeme.
Das Singulator System mit seinenEinwegkartuschen passt auf eine kleine Arbeitsfläche und ermöglicht einereproduzierbare, schnelle und unkomplizierte Auftrennung von Gewebe inEinzelzell- oder Zellkernsuspensionen. Forscher können nun auf einfacheWeise Suspensionen von Zellkernen oder hochvitalen Zellen für eine Vielzahl vonEinzelzellanalysen aus nur 2 mg festem Gewebe gewinnen.
Der „Singulator“ ist ideal fürGenomik, Zellbiologie und andere 'omics'-Anwendungen, einschließlich scRNA-Seq,snRNA-Seq, ATAC-Seq, CITE-Seq, FACS und Immuno-Onkologie. S2 Genomics bietet eine Auswahl an voreingestellten Protokollen undvorformulierten Reagenzien für die Zellisolierung aus einer wachsenden Anzahlvon Maus-, Ratten- und Humangeweben, einschließlich Tumoren.
Mit der intuitiven Software kann der Benutzer aus einerAuswahl von voreingestellten Protokollen und vorformulierten Reagenzien wählen.Der „Singulator“ bietet die Möglichkeit, eigene Protokolle mit anpassbarenParametern zu erstellen, einschließlich Zerkleinerung, Enzym-Inkubationszeit,Temperatur, Misch- und mechanische Aufschlussprofile, und optional könneneigene Reagenzien verwendet werden.
Mit dem schnell arbeitenden „Singulator 100 und 200“ könnenAnwender eine hohe Ausbeute mit hoher Lebensfähigkeit (70 – 95 %) sowiereproduzierbare Ergebnisse erzielen.
Der "Singulator 100" ist die kleinere Version für geringerenDurchsatz mit einer Arbeitsstation, einer Kartusche und einer Assay Position,während der "Singulator 200" jeweils zwei hat.
Der Singulator bietet Protokolle mitHeiz- und Kühlschritten (37 °C, Raumtemperatur oder 6 °C) zur Verarbeitung derProben. Die Kaltdissoziation minimiert die Expression von stressbedingten Genenwährend der Zellisolierung und trägt zur Erhaltung der RNA-Qualität bei derIsolierung von Zellkernen bei.
Bitte kontaktieren Sie uns fürdetaillierte Informationen oder besuchen unsere Webseite www.dunnlab.de.
Förderprogramme für klinische Studien
Klinische Studien - sowohl für Medikamente als auch für Medizinprodukte - sind kostenintensiv. Das macht entsprechende Fördermöglichkeiten umso interessanter. Leider bietet die nationale Förderlandschaft nicht viele Optionen, solch große Summen abzudecken, aber jeder Zuschuss kann helfen. Wir stellen Ihnen einige Möglichkeiten vor, die sich - mit Ausnahme der steuerlichen Forschungszulage - vor allem auf KMU fokussieren:
Spotlight on Understanding Vaginal Microbiome Dynamics with Organ Chips
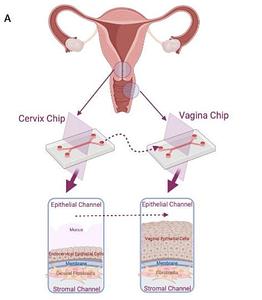
Researchers used Organ-on-a-Chip technology to investigate the impact of cervicovaginal mucus on dysbiotic vaginal conditions. The study, detailed in “Modulation of dysbiotic vaginal complications by cervical mucus revealed in linked human vagina and cervix chips by Gutzeit et al. (bioRxiv, 2023) doi: https://doi.org/10.1101/2023.11.22.568273, highlights dysbiotic changes in the female genital microbiome and their links to various health issues. The study employed a microfluidic two-channel co-culture of a cervix chip and a vagina chip, revealing that cervical mucus collected from the cervix chip protected the vaginal epithelium on the vagina chip from inflammation and epithelial cell injury. Proteomic analysis identified potential diagnostic biomarkers or therapeutic targets for bacterial vaginosis. The research underscores the utility of organ chip technology in understanding female reproductive tract health and disease.
Notably, the wide range of cells, media, and coating reagents required for establishing the Organ Chips are available in Europe through CellSystems®:

